12月28日,国家药品监督管理局网站显示,首个按古代经典名方目录管理的中药复方制剂(即中药3.1类新药)苓桂术甘颗粒通过技术审评,获批上市。药品上市许可持有人为江苏康缘药业股份有限公司。
苓桂术甘颗粒来源于古代经典名方苓桂术甘汤,由茯苓、桂枝、白术、甘草四味药组成,是国家中医药管理局发布的《古代经典名方目录(第一批)》中的第19方,以及《古代经典名方关键信息表(7首方剂)》中的第1方。
业内普遍认为,古代经典名方经过长期临床验证,疗效确切,具备极高的产业转化价值,更是造就了日本“汉方药”的市场成功;坚持以“临床需求为导向”的研发模式,建立中医药理论、人用经验、临床试验相结合的中药特色审评证据体系,将有助于引导和促进未来中医药创新研发迸发新活力,为中药现代化、国际化提供高质量发展支撑。
如今,康缘药业推开了“古代经典名方”复方制剂创新转化的一扇窗口;中医药产业创新正在迎来蓬勃发展的良好势头,“古代经典名方”将有怎样的新机会?
推动“经典名方”二次开发
业内专家分析指出,经典名方由于历史和技术的原因,需要科学设定工艺参数,实现产品均一稳定,用网络药理学、现代循证医学方法,推动临床再评价,推动产品的二次创新开发。
康缘药业本次按古代经典名方目录管理的中药复方制剂的中药3.1类新药——苓桂术甘颗粒,是《金匮要略》温阳化饮法治疗“痰饮病”的代表方,具有温阳化饮、健脾利湿的功效。书中记载:“心下有痰饮,胸胁支满,目眩,苓桂术甘汤主之”;“夫短气有微饮,当从小便去之,苓桂术甘汤主之”。
据了解,在苓桂术甘颗粒的开发中,除了建立符合中药特点的药材—饮片—中间体—制剂全过程、多维度的质量控制体系,保障质量稳定可控外,还基于“有效性”的经典名方“基准样品”,以工序损耗前置设计复方制剂工艺路线,有效地缩小了“实验室小试—中试放大—生产验证”转换过程中物质传递的差距;同时创新性采用芳香水直接包合的方法,解决苓桂术甘汤中挥发性成分的保留问题。
专家表示,经典名方现代研发是对接国家战略发展需求、人民健康服务要求的重要载体。此次苓桂术甘颗粒通过技术审评获批上市,将有利于促进我国古代经典名方在现代临床更广泛的使用,并有助于提升中医临床服务水平及患者用药的便捷性。
事实上,中成药在部分疑难杂症以及慢性病领域具备一定优势,尤其是呼吸系统疾病用药,长期以来都是中成药的强势领域。叠加公众健康需求和疫情防控需要,呼吸领域中成药的研发热度持续高涨,多款中药新药获批上市:
2020年5月,以岭药业开发的6.1类新药连花清咳片获批上市,成为其继连花清瘟后在该领域的又一重磅新品;
2021年3月,由“抗疫三方”成功转化的清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒这“三药”获批上市;
2021年11月,康缘药业的银翘清热片获批,该产品是新中药注册分类实施以来首款获批的呼吸系统中成药1类新药;
2022年10月,康缘药业3.2类新药散寒化湿颗粒获批上市,用于寒湿郁肺所致疫病。最新消息指,该产品于11月23日起陆续在线下线上进行销售。
康缘药业的中成药新药研发可谓是一骑绝尘。米内网数据显示,除上述多款已获批新药外,康缘药业目前还有5款新药仍在积极开展临床,包括热毒宁颗粒、芪白平肺颗粒等,涉及流行性感冒、支气管哮喘、慢阻肺等适应症。
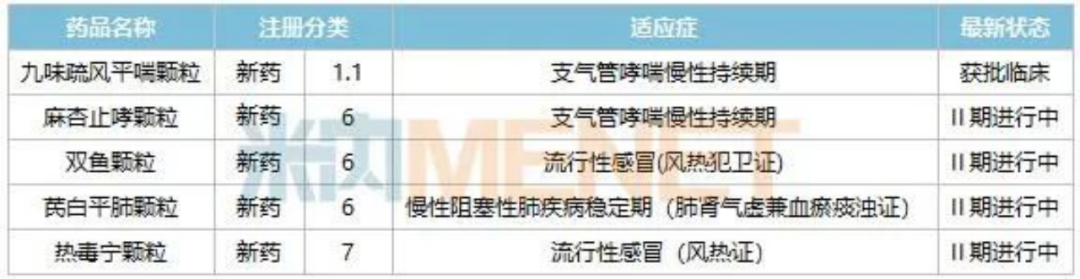
康缘药业在研的呼吸系统中成药新药情况
同样在呼吸领域加大研发力度的,除了康缘药业,还有健民药业、卓和药业、亚宝药业等。据悉,健民药业的小儿紫贝止咳糖浆、卓和药业/亚宝药业的风叶咳喘平口服液等产品,均在积极推进产品研发。
“三结合”促进中药创新转化
由“方”变“药”的中药新药,其转化过程是“源于临床、回归临床”的生动实践,也意味着具有中医药特色的注册审评路径逐渐走通。
早在2008年,《中药注册管理补充规定》发布,提出“来源于古代经典名方的中药复方制剂,可仅提供非临床安全性研究资料,并直接申报生产”;2016年国家颁布了《中华人民共和国中医药法》,2018年《古代经典名方目录》正式发布,进一步让医药产业对古代经典名方予以关注。
近年来,国家发布了系列政策文件指导中医药工作,明确将中药新药创制作为中医药发展的重点任务之一,建立中医药理论、人用经验、临床试验相结合的中药特色审评证据体系(下称“三结合”审评证据体系),为中药新药研发带来了新的历史发展机遇。
2019年10月发布的《中共中央国务院关于促进中医药传承创新发展的意见》,提出了“三结合”审评证据体系的要求;
2020年10月发布的《中药注册分类及申报资料要求》对中药注册分类进行调整,重点优化了体现中药特点的中药复方制剂的注册申报路径,丰富了古代经典名方中药复方制剂范围;
2022年5月发布的《基于人用经验的中药复方制剂新药临床研发指导原则(试行)》和《基于“三结合”注册审评证据体系下的沟通交流指导原则(试行)》,进一步推动构建了中医药理论、人用经验和临床试验相结合的中药注册审评证据体系。
在“三结合”政策推动下,国家药监局挥出促进中医药传承创新发展的组合拳,激发了中药创新活力,中药新药临床试验和上市申请数量均呈现回暖趋势,中药创新药研发进入蓬勃发展时期。
据统计,近年来中药新药上市申请的批准量稳步增加,从2017年至2020年一共批准了8款中药新药,2021年批准了中药新药12个,数量远超以往。

2021年NMPA批准的中药新药
聚焦未被满足的临床需求,以人民群众健康为中心,遵循中医药规律,简化审批程序,深化中药注册领域改革,将古代经典名方发扬光大,是新时期传承创新中医药的切入点和突破口。
专家指出,坚持以临床价值为导向,构建中医药理论、人用经验和临床试验“三结合”的中药审评证据体系,推动建立与中药临床定位相适应、体现其作用特点和优势的疗效评价标准,正在成为新时期中医药迈向高质量发展的重要创新路径。
免责声明:本网站内容来自作者投稿或互联网转载,目的在于传递更多信息,不代表本网赞同其观点或证实其内容的真实性。文章内容及配图如有侵权或对文章观点有异议,请联系我们处理。如转载本网站文章,务必保留本网注明的稿件来源,并自行承担法律责任。联系电话:0535-6792766




